
新(xīn)聞資訊
首頁(yè) >> 新(xīn)聞資訊 >> 公(gōng)司新(xīn)聞
VDS引流技(jì )術的作(zuò)用(yòng)機制
作(zuò)用(yòng)機制:負壓力封閉式VSD引流技(jì )術(的機理(lǐ)是運用(yòng)醫(yī)療高分(fēn)子泡末材質(zhì)做為(wèi)負壓力引流管和創口間的中(zhōng)介,高負壓力曆經引流管傳送到醫(yī)療泡末材質(zhì),且分(fēn)布均勻在醫(yī)療泡末材質(zhì)的表層,因為(wèi)泡末材質(zhì)的高寬比延展性,負壓力可(kě)以抵達被引流區(qū)的每一點兒,産(chǎn)生1個全面的引流。很(hěn)大快的、材質(zhì)不太硬的小(xiǎo)塊引出來物(wù)在高負壓力效果下被切分(fēn)和塑産(chǎn)生顆粒,曆經泡末材質(zhì)的縫隙進到引流管,再被快速消化吸收搜集器皿。而很(hěn)有(yǒu)可(kě)能(néng)阻塞引流管的塊狀引出來物(wù)則被泡末材質(zhì)阻攔,隻有(yǒu)依附在泡末材質(zhì)表層,在除去或拆換引流時于泡末材質(zhì)一同離去人體(tǐ)。根據封閉式創口與外部阻隔,避免環境污染和互相污染,并确保負壓力的不斷存有(yǒu)。不斷負壓力使創口滲出液馬上被抽走,進而合理(lǐ)維持創口清理(lǐ)并抑止病菌生長(cháng)發育。因為(wèi)高負壓力曆經做為(wèi)中(zhōng)介的綿軟的泡末材質(zhì)分(fēn)布均勻于被引流區(qū)的表層,可(kě)以合理(lǐ)地避免傳統式負壓力引流時很(hěn)有(yǒu)可(kě)能(néng)産(chǎn)生的器官被吸起或受力而導緻的缺血性、萎縮、穿孔等病發症。
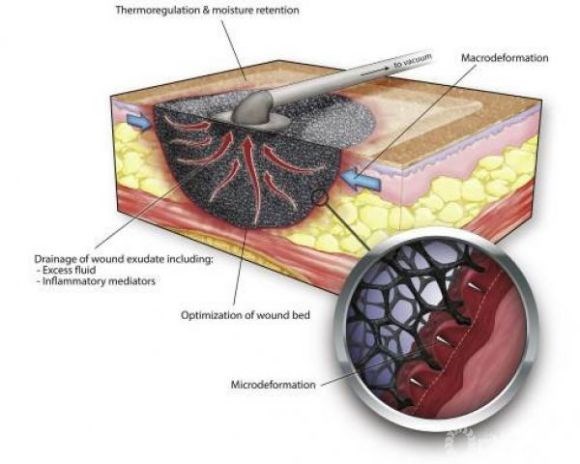
VSD引流顯而易見,在這個高效率引流系統中(zhōng),被引流區(qū)的滲出液和萎縮機構将立即的被消除,被引流區(qū)域内可(kě)做到“零堆積”,創口可(kě)以迅速地得到清理(lǐ)的自然環境。在有(yǒu)很(hěn)大的腔隙存有(yǒu)時,腔隙也将因高負壓力的存有(yǒu)而加快變小(xiǎo)。對淺表創口,透性粘帖薄膜和泡末材質(zhì)構成複合性敷料,使部分(fēn)自然環境更貼近生理(lǐ)性的潤濕情況。高負壓力與此同時也有(yǒu)益于部分(fēn)血循環的改進和組織水腫的消散,并刺激性上皮組織生長(cháng)發育。
組織學(xué)檢查證實,因為(wèi)負壓力的效果,降低了機構間壓力,與此同時使傷口周圍的氧張力下降,刺激性修複的啓動信号,有(yǒu)益于立即消除萎縮機構,促使人體(tǐ)分(fēn)泌纖溶蛋白激活物(wù)及其它酶的釋放,傷口内産(chǎn)生纖維蛋白溶解,可(kě)增強膠原機構的生長(cháng)發育,并創造出加快纖維蛋白溶解的自然環境,進行自溶性清創[2],原癌基因c2fos、基質(zhì)金屬蛋白酶(MMP)等的表達均下降,c2fos的減少又(yòu)部分(fēn)或完全阻斷了MMPs的表達,使創口細胞表達的膠原成分(fēn)得到了保護,膠原的降解受到了控制,阻止了膠原蛋白的喪失,進而加快了慢性創口的愈合;封閉式負壓力引流避免了傷口表層神經末梢暴露而産(chǎn)生萎縮,而感覺神經系統不僅可(kě)以将感覺信号傳入中(zhōng)樞神經,而且參與皮膚的多(duō)種反應,它可(kě)以分(fēn)泌出各種遞質(zhì),介導皮膚中(zhōng)的大量細胞在傷口的愈合中(zhōng)起效果,如它所分(fēn)泌的神經肽,感覺神經肽參與修複過程中(zhōng)的炎性反應,介導生長(cháng)因子在信号網絡中(zhōng)起效果。另外,神經肽對免疫系統亦有(yǒu)效果,如巨噬細胞、淋巴細胞和肥大細胞等,使之發揮了其應有(yǒu)的功能(néng),促進傷口愈合。
VSD引流負壓力封閉式引流的創口淋巴細胞浸潤消散較快,增生期膠原合成出現較早,修複期可(kě)見到收縮性纖維合成增強。有(yǒu)學(xué)者認為(wèi)這一技(jì )術能(néng)顯著提高創口的血流量,促進萎縮機構和病菌消除。能(néng)加快創口上皮組織生長(cháng)發育和修複細胞增殖,又(yòu)能(néng)增加毛細血管流量,促進毛細血管新(xīn)生,還能(néng)降低創口中(zhōng)基質(zhì)免疫蛋白酶活性,增加纖維連接蛋白含量。
